- 中国
- 法律・法改正
2021.08.27
特許第2部:峰岸 真紀、牛島 倫太郎
2021年6月1日に施行された中国専利法第4次改正法では、第76条において医薬品特許紛争早期解決メカニズム(いわゆるパテントリンケージ制度)の創設が定められました。この度、以下の通り、種々の規定が公表されたことにより、中国におけるパテントリンケージ制度の詳細が明らかになりました。
2021年7月4日にパテントリンケージ制度の詳細な規定として、中国国家薬品監督管理局(National Medical Products Administration:以下、「NMPA」と略記)および中国国家知識産権局(China National Intellectual Property Administration:以下、「CNIPA」と略記)が「医薬品特許紛争の早期解決メカニズムの実施弁法(試行)」(以下、「実施弁法」と略記)を公布し、同法は即日施行されました。また、同日、NMPAは「医薬品特許紛争の早期解決メカニズムの実施弁法に関する実施の通知」(2021年第46号)を発行し、中国上市医薬品特許情報登録プラットフォーム(以下、「特許情報登録プラットフォーム」と略記)(https://zldj.cde.org.cn/home)が正式に運用されることを示しました。
2021年7月4日に中国最高人民法院(以下、「最高裁」という)が「登録申請医薬品に関連する特許紛争民事事件の審理における法律適用の若干問題に関する規定」(以下、「最高裁の規定」と略記)を公表し、2021年7月5日にCNIPAが「医薬品特許紛争早期解決メカニズム行政裁決弁法」(以下、「CNIPAの規定」と略記)を公表し、両規定は2021年7月5日から施行されました。
本記事では、中国専利法第4次改正法および上記実施弁法、最高裁の規定、CNIPAの規定に基づき、以下のフローチャート(図1)を参照しながら中国におけるパテントリンケージ制度をご紹介します。
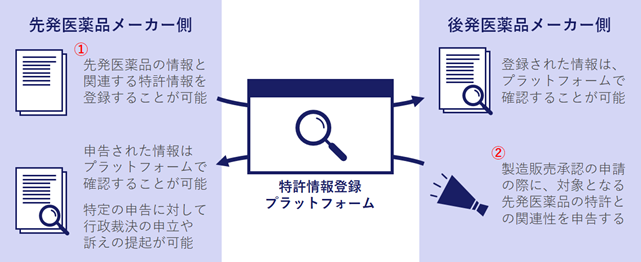
【図1】パテントリンケージ制度の概要
先発医薬品に関する特許権の情報登録(図1①)
登録期限
医薬品の製造販売承認を得た者は、中国で製造販売承認を取得した後、30日以内に特許情報登録プラットフォームに関連する特許権の情報を登録することができます。登録した特許情報に変更が生じた場合は、30日以内に更新しなければなりません。特許権の情報を特許情報登録プラットフォームへ登録しなかった場合は、パテントリンケージ制度の適用はありません。(実施弁法第4条)
実施弁法では、2021年7月4日以前に承認された医薬品の特許情報の特許情報登録プラットフォームへの登録時期については言及されていませんが、速やかに登録するのが望ましいと思われます。
登録内容
特許情報登録プラットフォームへ登録が可能な特許権の種類(※)は以下の通りです。
・化学医薬品…有効成分の化合物の特許権、有効成分を含む組成物の特許権、および医薬用途に関する特許権(実施弁法第5条)
・生物製剤…有効成分を配列構造で特定した特許権、および医薬用途に関する特許権(実施弁法第12条)
・中国の伝統薬…組成物の特許権、抽出物の特許権、および医薬用途に関する特許権(実施弁法第12条)
なお、中間体、代謝物、結晶形、製造方法、または検査方法に関する特許権は登録の対象となりません。(実施弁法の政策解読 項目四)
なお、後述のように、化学医薬品と、生物製剤および中国の伝統薬では、パテントリンケージ制度における取り扱いが異なります。
特許情報登録プラットフォームに登録すべき情報は以下の通りです。(実施弁法第4条)
・医薬品の名称
・剤形
・規格
・医薬品の製造販売承認を得た者
・関連する特許番号
・特許権の名称(発明の名称)
・特許権者
・特許権のライセンスを受けた者
・特許権の付与日及び保護期間の満了日
・特許権の状態
・特許権の種類(上記※に対応)
・医薬品と関連する特許権の請求項との対応関係
・宛先住所
・連絡者(担当者氏名)
・連絡先(電話番号、Eメールアドレスなど)
医薬品の製造販売承認を得た者は、その登録した関連情報の真実性、正確性及び完全性について責任を負うこととなります。また、異議を受けた場合には、遅滞なく照合し、記録しなければなりません。以下も明記されています。(実施弁法第4条)
・登録情報は、特許権の登録原簿、特許公報および薬品登録証書における情報と一致しなければならない。
・医薬用途に関する特許権は承認を受けた医薬品の説明書における適応症又は効能効果と一致しなければならない。
・登録した特許権の技術的範囲は、承認された医薬品の技術方案を包含しなければならない。
後発医薬品の製造販売承認申請者による申告(図1②)
後発医薬品の製造販売承認申請者は、その申請をする際に、特許情報登録プラットフォームに登録されている、関連する先発医薬品の特許権ごとに、声明を提出する必要があります。声明には4種類あります。(実施弁法第6条)
声明(1)…対象となる先発医薬品について、いかなる特許情報も特許情報登録プラットフォームに掲載されていない。
声明(2)…特許情報登録プラットフォームに登録されている、対象となる先発医薬品の特許はすでに失効し、もしくは無効が確定している。または、後発医薬品の製造販売承認申請者が対象となる特許権の実施許諾を受けている。
声明(3)…対象となる先発医薬品の特許権が特許情報登録プラットフォームに登録されているが、当該特許権の存続期間が満了するまで後発医薬品を製造販売しないことを承諾する。
声明(4)…特許情報登録プラットフォームに登録されている、対象となる先発医薬品の特許は無効と認められるべきであり、または申請する後発医薬品は当該特許権の保護範囲には包含されない。
中国国家薬品監督管理局の医薬品審査評価センター(NMPAの技術的審査評価機関)(Center for Drug Evaluation:以下、「CDE」と略記)は、申請の受理から10営業日以内に、特許情報登録プラットフォームにおいて、申請情報および関連する声明を公開します。後発医薬品の製造販売承認申請者は、CDEによる申請の受理から10営業日以内に、先発医薬品の製造販売承認を得た者に対し、特許情報登録プラットフォームに登録された電子メール宛および郵送で、申請情報および声明を通知するとともに関連する記録を残さなければなりません。声明(4)によって、申請する後発医薬品は当該特許権を侵害していないと主張する場合は、後発医薬品の技術方案と関連する特許権のクレーム対比表および関連する技術的な資料を送付しなければなりません。先発医薬品の製造販売承認を得た者が関連する特許権の特許権者とは異なる場合には、製造販売承認を得た者が特許権者に通知します。(実施弁法第6条)
その後の流れを、以下のフローチャート(図2)を参照しながらご紹介します。
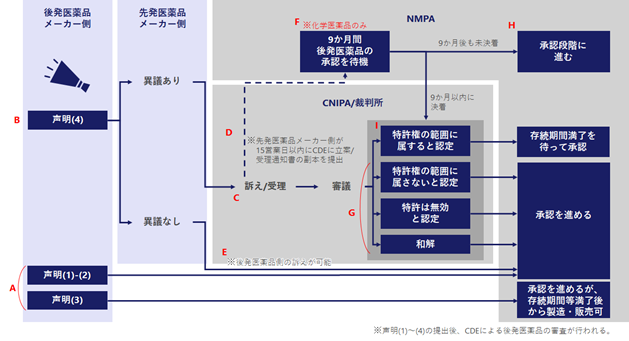
【図2】後発医薬品の製造販売承認申請者が声明を提出した後の流れ
提出された声明の種類に基づく、その後の流れ
声明(1)または(2)が提出された場合…技術評価結果に基づき、製造販売承認申請について、NMPAによる審査承認段階に移行します。(実施弁法第10条)(図2のA)
声明(3)が提出された場合…技術評価結果に基づき、製造販売承認申請について、NMPAによる審査承認段階に移行します。ただし、後発品の販売ができるのは、関連する特許権の満了後および後述の市場独占期間(実施弁法第11条)満了後となります。(実施弁法第10条)(図2のA)
声明(4)が提出された場合…特許権者側による訴えの提起等が可能です。詳細は後述します。(図2のB)
声明(4)が提出された場合の流れ
特許権者側による訴えの提起がある場合
声明(4)に異議のある特許権者または利害関係人は、製造販売承認申請書が公開された日から45日以内に、裁判所への訴訟の提起またはCNIPAへの行政裁決の請求を行い、後発医薬品が関連する特許権の保護範囲に属するか否かの判断を求めることができます。(実施弁法第7条)(図2のC)
利害関係人には、当該特許権者からライセンスを受けた者および関連の医薬品に関する販売承認を取得した者が含まれます(最高裁の規定第2条、CNIPAの規定第4条(一))。
特許権者側は、裁判所に提訴しまたはCNIPAに裁決請求を行った場合において、事件が受理された日から15営業日以内に、CDEに受理通知の写しを送付し、かつ後発医薬品の製造販売承認申請者に通知する必要があります。(実施弁法第7条)(図2のD)
特許権者側による訴えの提起がない場合
特許権者または利害関係人が上述の期間内に訴えを提起せず、かつ裁決請求を行わなかった場合、NMPAは技術評価の結論及び後発医薬品の製造販売承認申請者により提出された声明の状況に基づいて、直接製造販売承認をするか否か、決定することができます。(実施弁法第8条)(図2のE)
特許権者または利害関係人が上述の期間内に訴えない場合、後発医薬品の製造販売承認申請者は、後発医薬品が関連特許権の保護範囲に包含されないことを確認するため、裁判所への訴訟の提起またはCNIPAへの行政裁決の請求が可能です。(実施弁法第8条、CNIPAの規定第4条、最高裁の規定第4条)(図2のE)
上述のように、特許権者もしくは利害関係人または後発医薬品の製造販売承認申請者が訴えを提起する先として、裁判所またはCNIPAを選択できます。相違点を以下に記載します。
CNIPAへの行政裁決の請求
CNIPAは、担当部局として医薬品特許紛争早期解決メカニズム行政裁決委員会を編成します(CNIPAの規定第2条)
CNIPAへの行政裁決の請求のための必要書類は以下の通りです。(CNIPAの規定第7,8条)
・主体となる資格に関する証明(例:現在事項全部証明書)
・特許情報登録プラットフォームに登録された特許権の関連情報
・特許情報登録プラットフォームに登録された医薬品製造販売承認の申請書
・声明(4)とその根拠
・後発医薬品の製造販売承認申請者が行政裁決を求める場合、申請者は登録申請した医薬品の関連する技術方案を提出する必要がある。
当事者がすでに裁判所に訴えを提起している場合にはCNIPAへの裁決申請は受理されません(CNIPAの規定 4条(5)、10条(9))。なお、先にCNIPAに裁決を請求した後でも、裁判所に訴訟を提起することは可能です(最高裁の規定第5条)。
また当事者の希望に応じて、CNIPAは調停による解決を図ることができます。調停が成立しない場合は、CNIPAは裁決を行います(CNIPAの規定第15条)。裁決には、後発医薬品が関連する特許権の保護範囲に包含されるか否か、その理由および根拠が記載されます。そして裁決は当事者に送達されるとともにNMPAに回覧され、「政府情報公開条例」に従い社会に一般公開されます(CNIPAの規定第18条)。
当事者がかかる裁決に不服の場合には、裁判所に行政訴訟を提起することが可能です(実施弁法第7条、CNIPAの規定第19条)。
裁判所への訴訟提起
裁判所に訴訟を提起する場合は、管轄の裁判所は北京知識産権法院です。(最高裁の規定第1条)
特許権者側が先にCNIPAに裁決請求をしていても、裁判所では訴えが受理されます(最高裁の規定第5条)。さらに関連する特許権の無効審判の請求がCNIPAで受理されていることを理由に訴訟の中止(stay)の申し立てがなされても、裁判所は原則この申立てを認めません(最高裁の規定第6条)。
必要な書類は以下の通りです。(最高裁の規定第3条等)
・主体となる資格に関する証明(例:現在事項全部証明書)
・特許情報登録プラットフォームに登録された特許権の情報(発明の名称、特許番号、関連する請求項など)
・特許情報登録プラットフォームで公開された製造販売承認申請に係る後発医薬品の情報(医薬品の名称、医薬品の種類、登録の種類、後発医薬品と先発医薬品の対応関係を含む)
・声明(4)とその根拠
・CDEに提出した、関連する特許権の保護範囲に包含されるか否かの認定に必要な技術資料のコピー(後発医薬品の製造販売承認申請者は提出要)
また、裁判所において、後発医薬品の製造販売承認申請者は、以下の主張をすることができます。
・後発医薬品の技術が既存の公知技術に属する(公知技術の抗弁:専利法第67条)又は、
・後発医薬品は関連する特許権の出願日前に製造および/または使用をしており、元の範囲内においてのみ引き続き製造および/または使用する(先使用権の抗弁:専利法75条2項)
裁判所は、これを事実と認定した場合には、「後発医薬品は関連する特許権の保護範囲には属さない」と判決することができます。(最高裁の規定第7条)
特許権者または利害関係人が、保全の目的で、関連する特許権の存続期間中に、後発医薬品の製造、使用、販売の申し出、販売、または輸入の禁止を求めた場合、裁判所はこの訴えを審理の対象とします。しかし、裁判所は、後発医薬品のNMPAへの申請行為または審査承認行為の禁止の請求は認めません。(最高裁の規定第10条)
化学後発医薬品の製造販売承認の待機期間
化学後発医薬品の製造販売承認手続において、特許権者または利害関係人から訴訟の提起又は行政裁決の申請がなされた場合、NMPAは、裁判所が立件しまたはCNIPAが裁決申請を受理した通知書を受け取った日から9か月間の待機期間を設定します。待機期間が設定されるのは一度のみです。なお、待機期間中、CDEは技術評価を停止しません。(実施弁法第8条)(図2のF)
待機期間中、特許権者、利害関係人、または化学後発医薬品の申請者は、裁判所からの判決書又はCNIPAからの決定書等を受領した日から10営業日以内に、関連文書をCDEに送付しなければなりません。(実施弁法第9条)
化学後発医薬品の製造販売承認の流れ
声明(4)が提出された場合、技術評価を通過した化学後発医薬品の製造販売承認申請において、CDEは裁判所の有効判決またはCNIPAの行政裁決に基づき、相応の処理を行います。(実施弁法第9条)
1.以下のいずれかの場合、化学後発医薬品の製造販売承認申請は、NMPAによる審査承認段階に移行します。
・化学後発医薬品が特許権の保護範囲に含まれていないか、当事者が和解した場合(実施弁法第9条(二))(図2のG)
・特許が無効と判断された場合(実施弁法第9条(三))(図2のG)
・9か月の待機期間内に裁判所による確定判決や調停書、CNIPAによる行政裁決を受領しなかった場合(実施弁法第9条(四))(図2のH)
2.裁判所の確定判決やCNIPAの行政裁決により、化学後発医薬品が関連する特許権の保護範囲に包含されることが確認された場合、その製造販売承認申請は、特許権の存続期間の満了が近づくまで、NMPAによる行政審査承認段階に進むことはありません(実施弁法第9条(一)および(五))。(図2のI)
NMPAが製造販売承認を見合わせると決定した場合であって、以下の場合には、後発医薬品の製造販売承認申請者は、NMPAに製造販売承認を申請することができます。その後、NMPAは承認するか否か決定することができます。(実施弁法第9条)
・裁判所がCNIPAの裁決を覆した場合
・両当事者が和解した場合
・関連する特許が無効と判断された場合、または
・特許権者または利害関係人が、訴訟または行政裁決の請求を取り下げた場合
化学後発医薬品の市場独占期間
化学後発医薬品が、先発品に係る特許へのチャレンジに成功し、最初に製造販売承認を得られた場合には、12か月の市場独占期間が与えられます。その間、NMPAは同一種類の後発医薬品の製造販売承認はしません。ただし、この市場独占期間は、チャレンジされた特許権の存続期間は超えません。(実施弁法第11条)
ここで、「特許へのチャレンジが成功する」とは、化学後発医薬品の製造販売承認申請者が声明(4)を提出し、当該特許の無効請求に基づいて当該特許が無効となったことにより、後発医薬品の製造販売が承認されることを意味します。(実施弁法第11条)
生物製剤および中国の伝統薬に関するパテントリンケージ制度での取り扱い
バイオシミラー(バイオ後続品)および中国の伝統薬(同一名称、同一処方)においては、化学後発医薬品とは異なり、9か月の製造販売承認の待機期間はなく、市場独占期間もありません(実施弁法第12条)。
バイオシミラーおよび中国の伝統薬(同一名称、同一処方)の製造販売承認において、技術評価の結論に基づき、CNIPAは承認するか否かを決定します。裁判所またはCNIPAが、バイオシミラーおよび中国の伝統薬(同一名称、同一処方)の関連技術方案が特許権の保護範囲に包含されると確認した場合は、当該バイオシミラーおよび中国の伝統薬(同一名称、同一処方)は、関連する特許権の有効期間の満了まで製造販売承認はなされません。(実施弁法第13条)
後発品の販売承認後の紛争
化学後発医薬品、中国の伝統薬(同一名称、同一処方)、およびバイオシミラーが製造販売承認された後に、紛争が生じた場合には、専利法およびその他の関連法の関連規定に基づいて解決することができます。すでに承認された医薬品の製造販売承認が取り消されることはなく、その有効性にも影響はありません。(実施弁法第14条)
[担当]特許第2部:峰岸 真紀、牛島 倫太郎
[監修]顧問:張 華威(中国弁護士・日本付記弁理士)
参考
・中国国家薬品監督管理局および中国国家知識産権局による「医薬品特許紛争の早期解決メカニズムの実施弁法(試行)」(2021年7月4日施行)
https://www.cnipa.gov.cn/art/2021/7/4/art_74_160513.html
・中国国家薬品監督管理局による「医薬品特許紛争の早期解決メカニズムの実施弁法に関する実施の通知」(2021年第46号)(2021年7月4日付)
https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210703224608174.html
・中国最高裁判所による「登録申請医薬品に関連する特許紛争民事事件の審理における法律適用の若干問題に関する規定」(2021年7月5日施行)
http://www.court.gov.cn/fabu-xiangqing-311791.html
・中国国家知識産権局による「医薬品特許紛争早期解決メカニズム行政裁決措置」(2021年7月5日施行)
https://www.cnipa.gov.cn/art/2021/7/5/art_74_160566.html